張金堅:液體切片在癌症診療扮演的角色

本文摘自<常春月刊>502期
文/張金堅
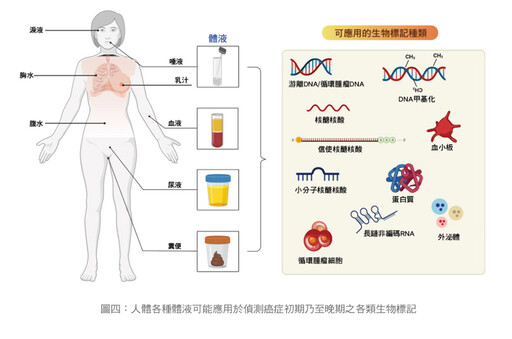
任何實體腫瘤都是透過組織病理切片進行確切的診斷,然而腫瘤組織切片會造成組織傷害且操作起來相對複雜,對於一些術後或轉移性癌患者來說,腫瘤體積太小、分散或腫瘤位置,有時並不適合進行組織切片。另外,組織活檢只能反映腫瘤在某一時間點的局部狀態,這樣可能會錯過某些腫瘤突變的資訊。液體切片是指從體液(包括血液、尿液、胸水、腹水、淚液及唾液等)中,獲得來源於各種組織的生物標誌物,並通過對所得的生物標誌物進行分析得到其來源組織的相關資訊。
液體切片的方便性,可以重複檢查、可用來追蹤、沒有疼痛、風險較低,受檢者不會恐懼,在腫瘤領域具有極大潛力和廣泛臨床應用價值。液體切片這個名詞是Alix-Panbieres和Pantel在2010年首次發表的,當時是用來描述血液循環腫瘤細胞(Circulation Tumour Cell, CTC),但很快的,這個名字就擴大到血液循環腫瘤DNA(Circulation Tumour DNA, ctDNA)。雖然早在1869年Thomas Ashworth就提出CTC的概念,而一直到1948年才有法國科學家Mandel等人描述ctDNA。然而,CTC的高偽陽性和高偽陰性限制了它的臨床實用性,而讓ctDNA後來居上,成為液體切片的主角。
在臨床腫瘤學中,首次驗證ctDNA則是2014年檢測大腸癌患者中的KRAS/BRAF突變,然後在2020年,將ctDNA用於檢測非小細胞肺癌中EGFR基因的突變,而後相繼有其他癌症包括乳癌等之相關報告。本文將從液體切片在癌症的篩檢、早期診斷、監測病情變化、預測預後、探索耐藥機制,以及新藥研發等方面進行闡述,並與讀者分享。
液體切片主要檢測對象
❶循環腫瘤DNA(circulating tumor DNA, ctDNA)
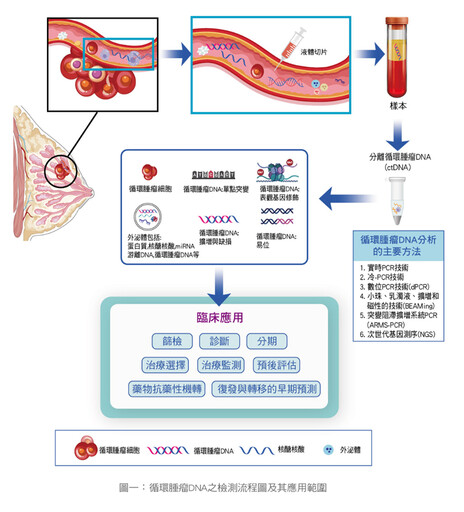
ctDNA是指人體血液循環系統中不斷流動的攜帶一定特徵,包括突變、缺損、插入、重排、轉位、拷貝數異常和甲基化等來自腫瘤基因組的DNA片段;ctDNA的主要來源包括:壞死的腫瘤細胞、凋亡的腫瘤細胞、循環的腫瘤細胞、腫瘤細胞分泌的外泌體。當癌細胞壞死或凋亡時,釋放出漂浮在血液中的基因組片段,即ctDNA。在晚期癌症患者中,腫瘤可能是血液中大部分循環游離DNA(cell-free DNA, cfDNA)的來源;ctDNA是一種敏感性和特異性較強的生物標誌物,廣泛應用於多種不同類型腫瘤的臨床研究。
但由於ctDNA所占比例較小,從正常cfDNA中難以區分ctDNA,對樣本中突變片段數量進行準確定量存在很多困境,因此,需要靈敏度和特異性較高的檢測方法。
過去DNA測序方法主要是第一代DNA測序方法,近年來,隨著次世代基因測序(next-generation sequencing, NGS)技術和數位PCR(digital PCR, dPCR)技術的發展,改變了檢測ctDNA的層級。目前,對於已知突變的ctDNA主要檢測技術有dPCR技術,及基於小珠、乳濁液、擴增和磁性(bead, emulsion, amplification and magnetic, BEAMing)的技術,以及突變阻滯擴增系統PCR(amplification refractory mutation system PCR, ARMS-PCR)技術,利用上述技術,可以分析DNA片段所得的訊息,其中包括腫瘤的基因突變、染色體異常、複製體變異和甲基化等狀態。
此外,ctDNA的含量與腫瘤體積有高度相關性,因此可作為腫瘤大小和分期的替代指標;同樣的,有研究證明ctDNA含量的起伏與疾病的進程高度相關,對於許多種類的癌症,它是一種有效而且非侵入性的療效監測方法。
ctDNA的應用範圍廣泛,包括早期癌症篩查、疾病監視、治療選擇和預後評估等:
◎早期診斷癌症:由於早期癌症往往無明顯症狀,難以被發現;ctDNA可以偵測出微小腫瘤細胞的存在,有助於癌症的早期發現和診斷,進而提高治療成功率。
◎長期監控癌症復發:對於第一到第三期的癌症患者,ctDNA可長期監控癌症是否復發。術後追蹤過程中,通過定期抽血檢測ctDNA,可以偵測血液中的突變基因比率的變化,提早發現復發跡象,並及早調整治療方案。
◎監控治療成效:由於液體切片是基於血液樣本的檢驗,因此可以在病人的整個治療過程中反覆進行,以便監控病情的變化。對於第四期的癌症患者,ctDNA能夠評估治療反應和換藥的時機。治療一段時間後,癌細胞可能產生抗藥性,ctDNA的數據及資訊可協助醫師評估治療成效,並及時調整藥物。
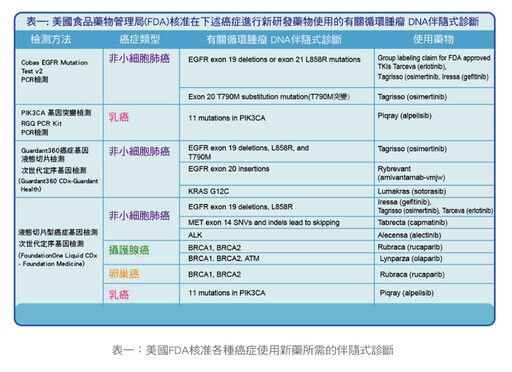
◎新藥研發:ctDNA能偵測特有的基因突變,如果有藥廠發展出相對應的治療藥物,就有機會增加療效。(如圖一、表一)
❷循環腫瘤細胞(circulating tumor cells, CTCs)
CTCs是從原發性或轉移性腫瘤組織流入周邊血液的罕見癌細胞,這些CTCs的表型和遺傳特徵,可以幫忙癌症分期和治療提供重要資訊,因此,進一步研究它們的特徵和性質,是一個相當有應用價值的醫學領域,也為液體切片提供細胞來源。在周邊血液中,約每106個-107個白細胞中可能僅有1個CTCs,因此CTCs富集(濃縮)分離(enrichment)是關鍵所在。CTCs檢測基本過程是先對其進行分離富集(濃縮),再進行分析。富集(濃縮)和分析的方法基於CTCs的物理和生物學特性,例如大小、變形性、密度、極性和電荷、上皮細胞黏附分子、細胞角蛋白和表達的腫瘤相關標誌物。
CTCs富集(濃縮)的方法主要有:密度依賴性細胞分離、基於細胞大小的分離、基於磁泳移動性的分離、免疫磁珠陽性富集(濃縮)和通過微流體裝置富集(濃縮)。目前唯一獲得美國FDA認證核可使用於臨床之CTC監測系統為CellSearchⓇ平台,即為使用EpCAM作為偵測標的。
CellSearch平台以半自動化磁珠篩選帶有EpCAM標記之細胞,並再以免疫螢光染色標定CK8、CK18、CK19,去除掉表現CD45之白血球,並以DAPI(4',6-diamidino-2-phenylindole,實驗室常用之DNA染劑)標記細胞核,進行全套CTC之篩選和純化,進化後即可進行量化測定。目前進行幾個臨床試驗中(例如TREAT CTC Trial),CellSearch平台在病人檢體中有得到一定程度的再現性之確認。綜合了體外及臨床檢體之分析,方得到現行通用之CellSearch平台轉移性癌症CTC門檻的數值,即每7.5cc血≧5 CTC。然而,CellSearch平台並非完美無缺點。
就原理上來說,CellSearch平台測得為帶有EpCAM之CTC。因此若由CTC表現較低密度或不表現EpCAM,就可能難以被CellSearch平台偵測。而CTC上EpCAM之表現量也有研究指出,有一定程度變異性,也可能隨時間變化,造成使用CellSearch平台判定之盲點。這也是CTC技術若要能更全面廣泛應用於癌症治療還需要克服的一大挑戰。(如圖二)

❸外泌體
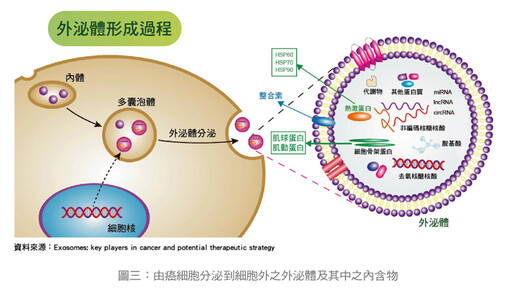
1983年,外泌體最先在綿羊的網織紅細胞(未成熟的紅血球佔所有紅血球中只有1%,英文叫reticulocyte)中被發現,外泌體是一種細胞源性囊泡,直徑為30nm~100 nm,它可以從血漿、唾液、尿液、乳汁、胸水、腦脊液和精液等多種體液中檢測到其內含有的蛋白質(如細胞因子、生長因子)和miRNA等生物活性物質,通過對腫瘤外泌體的檢測分析,可以得到腫瘤細胞的相關資訊。
外泌體提取的方法有:差速超速離心法、PEG沉澱法、聲波分離法、密度梯度離心法、過濾離心法、吸附法和免疫磁珠法等。外泌體的鑒定方法包括:電子顯微鏡、免疫膠體金標記技術、即時螢光定量聚合酶鏈式反應、流式細胞儀、奈米顆粒追蹤分析技術和測序等。
如上所述,外泌體除已經發現含有蛋白質外,外泌體中還含有大量的mRNA、miRNA、circRNA和DNA片段等核酸成份(如圖三),由於這些內含物提供了豐富的生物資訊,可以多方位、多角度的揭示出疾病(心血管、腎臟、神經退行性、代謝疾病和癌症)資訊,因而逐漸成為癌症生物標誌(biomarker)以及非侵入式液體切片(liquid biopsy)的新研究對象。
此外,以同樣應用在液體切片(liquid biopsy)的主種檢測標的進行比較,比起循環腫瘤DNA(Circulating tumor DNA, ctDNA)分離技術相當簡單和成熟,但是其為片段的DNA,並不是完整的基因資訊;而循環腫瘤細胞(Circulating Tumor cells, CTC)含有的資訊雖然較多且完整,但是因為數量很少,要從血液中分離出來,困難度較高,因此目前多用於研究。
而外泌體的來源廣泛,例如淋巴細胞、樹突狀細胞、肥大細胞及上皮細胞、腫瘤細胞等,都可以分泌外泌體,所分泌出的外泌體還會進入羊水、腹水、唾液、血清、血漿、母乳、尿液、精液、腦脊髓液和眼淚等諸多生物流體,因此極大的拓展了檢測途徑,提供了診斷易用性和加快檢測速度,也促使針對外泌體的「液體切片(liquid biopsy)」的發展,癌細胞的外泌體內含物與正常細胞不同,均可能成為癌症特有的生物標記。
以乳癌為例探討循環腫瘤細胞(CTCs)在診療上的應用
❶CTCs對於早期乳癌的角色
由於早期乳癌在周邊血液中,CTCs數量極少。到目前為止,在輔助化療方面尚無法證實在早期乳癌病人周邊血液中有CTCs的預後較差;但在術前進行化療方面,即所謂新輔助治療,於2018年有一項利用CellSearch平台大規模綜合分析了21個醫療中心,共計2774名病人,發現25.2%病人在化療前抽血有≧1顆CTC,與腫瘤大小相關、存活期、復發率都有顯著相關,但CTC數目與病理完全緩解無統計上的相關性。
❷CTCs對於晚期乳癌的角色
從2004年就有研究證實,在7.5cc全血中≧5顆CTCs的晚期乳癌病人預後較差。到2014年亦有一合併分析(pooled analysis),共納入1944名病人,亦證實同樣的結果。到目前為止,CTCs在轉移性乳癌已獲美國FDA證實對於預後及存活期的評估有其效力;但根據CTC數目變化而調整治療方式的策略,目前尚無共識,故FDA或各大癌症醫學會尚未將CTC納入治療選擇流程的評估指標。
❸Her-2表現在乳癌病人CTC扮演的角色
根據DETECⅢ第三期臨床試驗及CirCeTDM-1第二期臨床試驗,如果病理組織為Her-2陰性,但在周邊血液測得Her-2陽性的CTC時,使用抗Her-2之標靶藥物,則有較長的存活期,可見CTC如果轉變成Her-2陽性的話,要考慮使用對抗的標靶藥物。
液體切片面臨的困境與挑戰
儘管液體切片有許多利基,但是它也有一些限制與困境。第一,這些方法還不能提供腫瘤的所有訊息,諸如它不能提供腫瘤的確切位置或大小,目前的技術還不能確保獲得所有ctDNA的資訊,這可能會導致一些重要訊息的漏失。目前雖有美國FDA核准之二種ctDNA的檢測,還有一種CTCs的檢測,但到目前尚無統一的標準進行收集和分析ctDNA和CTCs,這可能會導致結果的不準確。
另外與液體切片相關的臨床試驗數據相對不多,因此,需進一步多發展與液體切片有關的臨床試驗,才能確定其在臨床上的實際效果。到目前為止,仍無法獨當一面在癌症的篩檢、診斷和監測方面扮演重要角色,仍需與其他檢測方法結合使用,才能獲得完整的訊息,有時在CTCs或ctDNA中發現抗藥性的機轉,但無對應的藥物可用。加上CTCs經過多體學的資料呈現,但仍有許多無法像傳統病理檢查能夠全面完整解釋,更值得一提的是所需檢測的步驟和程序非常繁瑣,而且費用非常高昂亦是要面對的挑戰。
結語
液體切片是一種新興的癌症檢測技術,目前較廣泛應用在周邊血液。其實在身體的各類體液亦具有潛力,像淚水、汗水、尿液、胸水、腹水,甚至乳汁、大便亦具有實用價值。它在篩檢、診斷、疾病進展、治療監測、復發預測、抗藥性機轉研究,乃至新藥研發都可以當作生物標記使用,將來可應用的範圍非常廣泛。
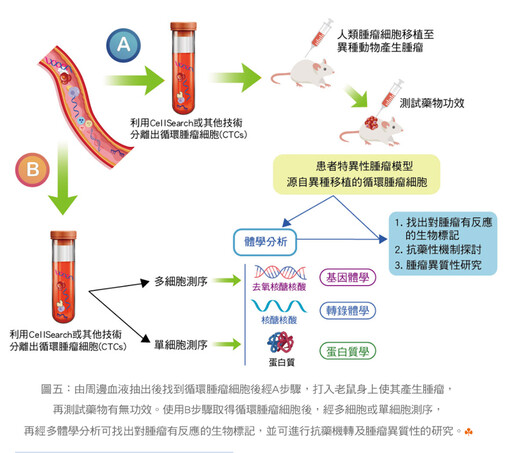
如果加上把人類CTC注射到老鼠身上長出腫瘤,亦可作為藥物效用的篩查。還有多體學及人工智慧的應用,及液體切片本身技術不斷的精進,將來必能更正確、更快速地預測癌症的發展,進而提供更多的治療方案,而且可以了解各種藥物抗藥性的機轉,可能衍生更多新藥的研發,改善病人的存活期及生活品質。(如圖四)、(圖五)
(圖片來源:Dreamstime/典匠影像)
最新健康新聞
-
-
嘉義市創意教案「健康沒缺碘」卡牌 社區營養全國展首度亮相
(1 小時前) -
觀光衛生品質離島食安不馬虎!臺東縣衛生局跨海餐飲從業人員衛生講習
(2 小時前) -
住宿式長照升級!北市推整合型住宿長照 醫療、照護、復健一次到位
(3 小時前) -
佛教僧伽醫護基金會啟動年度健檢 百位法師齊聚苗栗獲健康守護
(4 小時前)