幹細胞藥物獲國家藥物研發銀獎肯定 仲恩生醫預計明年申請上市

CNEWS匯流新聞網記者胡照鑫/台北報導
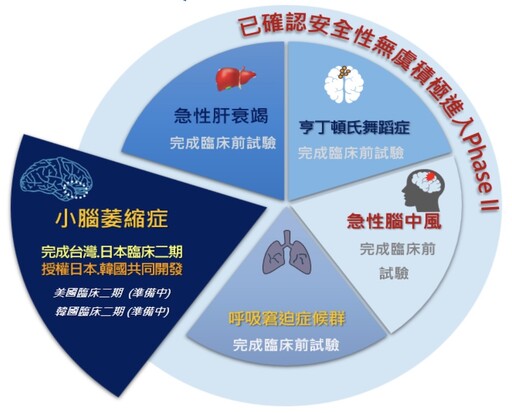
由衛福部與經濟部共同主辦的「2024國家藥物科技研究發展獎」,專注罕見疾病藥物開發的仲恩生醫,以Stemchymal應用在小腦萎縮症的人類異體脂肪來源間質幹細胞產品,在台灣神經罕見疾病的異體幹細胞藥物開發具領先地位,因此頒發銀質獎肯定。
創立於2007年的仲恩生醫,致力將脂肪間質幹細胞投入罕見疾病療法藥物研發,至今已累積多項創新幹細胞技術平台開發、前臨床及臨床試驗,適應症涵蓋小腦萎縮症與亨丁頓舞蹈症兩項罕病,以及急性缺血性腦中風、急性肝衰竭、急性呼吸窘迫症等急性發炎性疾病。
脊髓小腦萎縮症是一種罕見但致命的神經退化性疾病,仲恩生醫的幹細胞療法為患者帶來一線曙光。小腦萎縮發病於成年後期,且多為遺傳疾病。代表著患者的家庭可能因遺傳面臨重複的病症困擾,且病程不可逆,對患者與其家屬帶來極大的心理壓力與經濟負擔。
仲恩生醫董事長王玲美指出,研究團隊首先在基因改造的老鼠上模擬小腦萎縮,觀察其運動功能的退化。透過幹細胞注射,老鼠在跑步或攀爬等實驗中的平衡與穩定性有顯著提升,顯示幹細胞藥物有助於改善神經功能,對患者帶來一線生機。未來,透過前臨床與臨床的驗證,有機會可拓展至帕金森氏症、阿茲海默症等其他神經退化性疾病的應用。
王玲美指出,台灣、日本兩地已經完成臨床二期,受惠日本「藥品醫療器材法」及台灣甫通過之「再生醫療法」、「再生醫療製劑條例」等法令支持下,也啟動台日兩地取證行動,在日本將透過合作夥伴REPROCELL,積極準備申請日本「有條件式暫時性許可藥證」,台灣藥證部分,再生醫療雙法通過後,也爭取有附款許可暫時性藥證,為小腦萎縮症病友提供新藥使用權益,有望成為全球首項應用於SCA治療的幹細胞新藥。

仲恩生醫副總經理柯景懷表示,在取得日、台兩地暫時性藥證後,仲恩將依美國IND許可,與相關顧問團隊展開討論及規畫,預計2025年向FDA提出申請Phase2b臨床試驗執行,特別是今年7月美國FDA已接受Mesoblast的異體幹細胞療法生物製品許可申請,顯示FDA對再生醫療的正面支持,無疑替仲恩生醫的異體幹細胞療法在美國申請上注入一劑強心針。
柯景懷認為,目前小腦萎縮症的潛在市場,以病患人數而言,台灣約1,500人、日本約7,500人,美國人數則達到2萬5,000人,在日本,小腦萎縮相關疾病的年度治療費用可能約為300萬台幣,以日本7,500名病人中每年10%的滲透率,約750名病人即有相當可觀的收入目標,且由於病程的不可逆性,病人必須每年持續透過療程,使用人數有望逐年成長。
仲恩生醫表示,預計明年第一季申請科技事業函及啟動IPO計畫,審核約需3制6個月,若進展順利,可望將在2025年底申請上市櫃的相關程序,近期也將規劃現金增資用於加速營運發展及研發規模。
照片來源:CNEWS匯流新聞網資料照
《更多CNEWS匯流新聞網報導》
【文章轉載請註明出處】
最新生活新聞
-
大罷免無法叫停? 籲綠善用行政權
(14 分鐘前) -
雲端發票爭議調查結果出爐 財政部因這理由向廠商求償2400萬
(21 分鐘前) -
雲林馬鳴山遶境吃飯擔 體驗萬人吃飯擔吃平安
(26 分鐘前) -
彰化榮家開啟便利載送住民服務 彰榮小巴啟航
(56 分鐘前) -
勞動部高屏澎東分署辦輔導諮詢服務共識活動
(1 小時前)